Subtítulos:
Autores:
A citopatologia é o exame microscópico de células esfoliadas. A análise de alterações epiteliais celulares de forma preventiva teve seu início com raspados de colo de útero pela coloração de Papanicolau. Tal estratégia teve efeito significativo na redução na incidência e morbi-mortalidade do câncer do colo do útero. Nos Estados Unidos, houve uma redução de mais de 70% na incidência após o uso deste método de rastreio. Além disso, houve aumento nos anos de vida pós-diagnóstico, na qualidade de vida e nos óbitos evitados, devido à identificação precoce da patologia[1][2].
Tal metodologia foi primeiramente empregada nas células bucais esfoliadas no ano de 1951 por Montgomery and von Haam. Essa técnica é não invasiva, bem aceita pelos pacientes associada a um desconforto mínimo, permitindo o emprego de diferentes técnicas nas células obtidas pelo esfregaço[3].
Com o decorrer do tempo, o método de coleta de células bucais foi sendo aprimorado. Inicialmente, o material era coletado com auxílio de espátulas de metal ou de madeira. Posteriormente, iniciou-se o uso de escovas dentais macias e escovas propriamente desenvolvidas para tal finalidade, o cytobrush®. A citologia em meio líquido contribui para amostras com um menor número de artefatos, maior número de células bem distendidas e não sobrepostas concentradas numa menor área da lâmina. Observa-se, assim, uma baixa percentagem de esfregaços inadequados para análise[4] além da possibilidade de realizar diferentes técnicas a partir de um único esfregaço citológico. Como desvantagens, apresenta uma dificuldade de obtenção de células parabasais ou basais que certificam a abrangência de todas as camadas do epitélio bucal bem como exigência de equipamentos específicos como vórtex e centífuga, onerando o processo[4][5]. A “cytology-on-chip”, uma tecnologia mais avançada, caracteriza-se pela deposição de células em uma membrana que, posteriormente, é analisada digitalmente. Aproximadamente, 300 parâmetros celulares podem ser avaliados ao mesmo tempo neste processo[6].
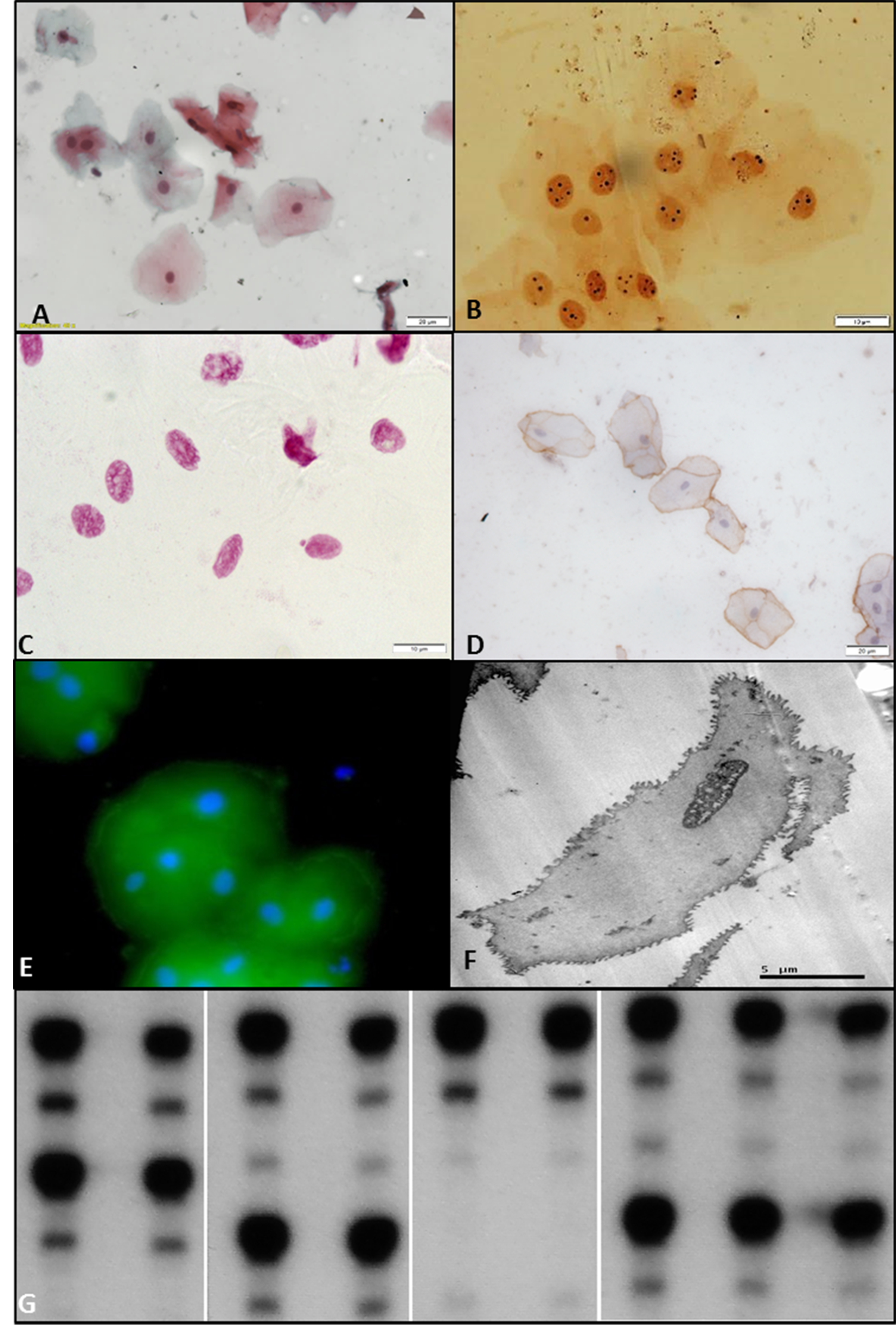
A partir do desenvolvimento de metodologias de análise aplicadas nas células bucais esfoliadas, diferentes resultados puderam demonstrar as alterações decorrentes da exposição a substâncias químicas, tais como: álcool, tabaco, crack, cocaína, formaldeído, temperos condimentados; bem como de radiações físicas como raios-X e radiação eletromagnética decorrente de aparelhos celulares. Outra importante aplicação da citopatologia bucal é na avaliação de lesões potencialmente malignas. Diversas técnicas podem ser aplicadas sobre as amostras citopatológicas bucais (Figura 1). Abordaremos neste capítulo, um breve histórico com os principais resultados da citopatologia bucal acumulados no Laboratório de Citopatologia Bucal da UFRGS. Estes estudos visaram rastrear alterações celulares da mucosa bucal, a fim de detectar precocemente o câncer de boca.
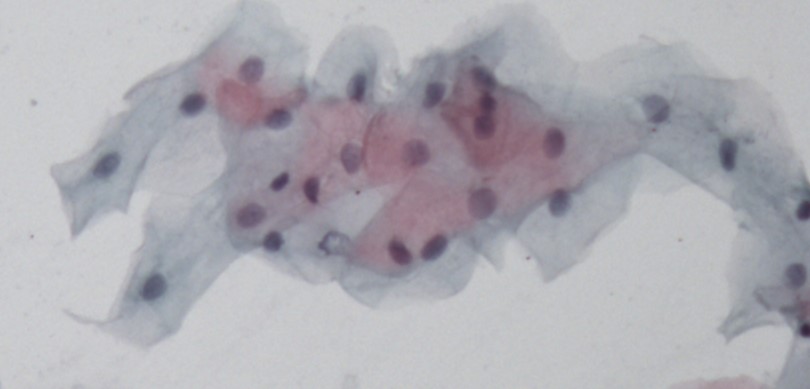
A técnica de Papanicolaou permite uma avaliação qualitativa e quantitativa. A qualitativa busca a presença ou não de células com características morfológicas suspeitas de malignidade, enquanto, através da quantitativa, avalia-se o padrão de maturação epitelial e os aspectos citomorfométricos.
Corroborando a literatura[7][8], a quase totalidade dos esfregaços citológicos dos estudos qualitativos realizados na Faculdade de Odontologia não detectaram alterações celulares específicas para suspeita de malignidade (classes III, IV ou V de Papanicolaou) em indivíduos expostos ao fumo e/ou álcool sem lesão bucal clinicamente visível[9][14]. Buscou-se, assim, a avaliar também os aspectos quantitativos.
A primeira pesquisa nesta linha foi realizada no ano de 1997, em indivíduos do gênero feminino, expostas ou não ao tabaco e ao álcool. As células avaliadas mostraram que os sítios anatômicos da mucosa bucal se comportaram de maneira distinta com padrões descamativos específicos. No lábio inferior, observou-se o predomínio de escamas anucleadas; na borda de língua o de células superficiais com núcleo e; no assoalho bucal o de células intermediárias[9]. O padrão de maturação peculiar das áreas anatômicas e o maior número de células anucleadas e intermediárias sob ação de fumo e/ou álcool, representando maior ceratinização e maior velocidade de renovação celular, respectivamente, foram corroborados por estudos posteriores[10]-[14]. Por fim, com o intuito de padronizar o método, estipulou-se que a contagem das 100 primeiras células é o suficiente para avaliar o padrão de maturação celular em fumantes e não fumantes sem lesão bucal[15].
Por volta do ano de 2000, iniciou-se o estudo citopatológico de lesões bucais – especificamente, as leucoplasias. Avaliaram-se raspados corados com a técnica de Papanicolau pré e pós-biópsia. Observou-se uma diminuição do número de células intermediárias (suspeitas) nos esfregaços pós-biópsia, sugerindo o uso da citopatologia como modelo de controle das lesões bucais[16]. Achado confirmado por Burzlaff et al.[14] que constataram maior número de células intermediárias e parabasais em leucoplasias displásicas em relação às não displásicas e mucosa bucal sem lesão clinicamente visível.
Em outro estudo, que considerava o padrão de maturação além de citomorfometria, mostrou valores aumentados de células parabasais nos grupos carcinoma espinocelular (CEC) e álcool/fumo quando comparado ao grupo controle. No grupo leucoplasia obteve-se valores aumentados de células anucleadas quando comparados aos demais grupos. Na análise qualitativa observou-se maior prevalência da classe I no grupo controle, exposto e leucoplasia e de amostras classe V para o grupo CEC. A análise citomorfométrica mostrou aumento da relação núcleo/citoplasma no grupo CEC quando comparados aos demais grupos. Valores quantitativos das células parabasais e da relação N/C podem ser padrões de avaliação para o desenvolvimento de alteração na mucosa bucal nos indivíduos expostos aos fatores de risco para CEC e no acompanhamento dos indivíduos com leucoplasias bucais[17].
Uma revisão sistemática realizada pelo grupo mostrou que a citopatologia quando pesquisada como método de rastreio para o diagnóstico precoce do câncer de boca apontou diferentes tipos de análises após a coloração por Papanicolau. As análises presentes nestes estudos foram predominantemente a citometria de DNA e classificação dos raspados por meio da análise quantitativa (Classe I, II, III ou IV). Os valores de sensibilidade destes dois testes de diagnóstico variaram de 23 a 94% e de 56 a 80%, respectivamente. Já a especificidade variou de 32 a 100% e 56 a 82%, respectivamente. A maior parte dos estudos não apresentava o valor da acurácia do método de diagnóstico estudado, no entanto, quando presente, a citopatologia obteve acurácia de 85,5 e 96%. Koch et al, 2011 sugerem em seu estudo que a citopatologia tem uma precisão limitada para o diagnóstico precoce do carcinoma espinocelular com menos de 20mm de diâmetro, mas acreditam que a citopatologia pode ser utilizada como uma ferramenta adicional no rastreamento do câncer bucal. No estudo de Fontes et al, 2012 os resultados indicaram que o diagnóstico citopatológico teve boa concordância com o diagnóstico histopatológico, apresentando alta sensibilidade e especificidade. Possivelmente análises conjuntas podem aumentar a acurácia da citopatologia para a detecção precoce do câncer de boca[17].
O aumento da velocidade de proliferação celular reduz o tempo para o processo de reparo do DNA, contribuindo para os múltiplos eventos genéticos da carcinogênese. A técnica das AgNORs avalia a velocidade de proliferação celular por meio da impregnação pela prata das proteínas associadas às NORs, que são as regiões organizadoras nucleolares responsáveis pela transcrição do DNA ribossômico. No ano de 2003, associaram-se as técnicas de Papanicolau e das AgNORs. Apesar da pequena amostra, observou-se uma correlação entre o aumento da área nuclear e o aumento da média do número das AgNORs/núcleo[18].
A média do número das AgNORs/núcleo, a porcentagem de células com mais de 3 ou 5 AgNORs/núcleo e a média da área das AgNORs são maiores em pacientes expostos ao fumo e a álcool em relação aos indivíduos não expostos. A exposição crônica destes carcinógenos aumenta a atividade proliferativa celular proporcionalmente ao tempo de exposição, principalmente sob o efeito sinérgico destes fatores[19][20]. A capacidade de monitoração deste marcador em pacientes fumantes e etilistas foi confirmada por meio de estudos longitudinais[20]-[22]. Em contraste, o uso de crack associado ou não a cocaína parece não afetar a velocidade de proliferação celular[23]. Nas lesões bucais, o volume e o número médios das AgNORs/núcleo. Estabeleceram-se pontos de corte do número médio das AgNORs/núcleo na distinção de lesões benignas e malignas: alguns autores consideram 6.524, outros mais de 70% das células do raspado com mais de 325 e 426.
A quantificação do micronúcleo (MN) é um biomarcador para detectar dano genético[27]. O MN é expresso em células em divisão que contêm cromossomos ou quebras de cromossomos acêntricos que não atingiram os pólos do fuso durante a mitose. Forma-se um envelope nuclear ao redor deste fragmento cromossomal, que adquire a morfologia de um núcleo em interfase, porém menor[28]. A avaliação deste biomarcador é um método confiável para rastreamento populacional de indivíduos expostos a carcinógenos[29][30]. Bohrer et al.[31] observaram maior frequência de MN com o sinergismo do fumo e álcool em relação ao grupo controle. A quantificação da frequência de MN também evidenciou o campo de cancerização[32]. O uso de crack/cocaína ocasionou o aumento da frequência de micronúcleos[33].
Alterações metanucleares foram observadas em células esfoliadas bucais expostas ao raio-X. A realização de radiografias panorâmicas aumentou o número de broken eggs, cariorrexe e binucleação, porém não modificou o número de micronúcleos comparando a avaliação antes e após a realização dos exames[34]. A exposição a fontes de radiação eletromagnética, como o telefone celular, demonstrou alterações na freqüência de danos citológicos na mucosa bucal. Indivíduos que usavam o telefone celular mais de 60 minutos/semana, há mais de oito anos, demonstraram aumento de alterações nucleares. Estes achados foram considerados, no entanto, dentro dos limites fisiológicos aceitáveis[35].
Em lesões potencialmente malignas (leucoplasias) e em CECs observou-se um aumento de micronúcleos e broken eggs em comparação ao grupo controle e aos indivíduos expostos a álcool e tabaco, respectivamente[32].
A literatura é controversa em relação ao real significado dos broken eggs e cariorrexe. O broken egg pode estar relacionado com genotoxicidade[36], com um processo degenerativo[37] ou ainda representar um processo adaptativo aos agentes clastogênicos[31]. A cariorrexe é uma alteração metanuclear relacionada a apoptose, sendo uma forma de eliminar células com dano genético[38], o que explicaria seu número aumentado em indivíduos expostos a carcinógenos[31][36]. Outros estudos, no entanto, observaram maior frequência da cariorrexe em indivíduos não expostos ao fumo ou álcool[32][39].
A Imunocitoquímica é utilizada para a avaliação de proteínas específicas em amostras biológicas. Para a sua realização, faz-se necessária a padronização de protocolos laboratoriais para cada anticorpo, garantindo resultados satisfatórios para as amostras citológicas bucais[40]. Estudo comparando imunocitoquímica com imunohistoquímica evidenciou que os padrões de marcação de E-caderina e Involucrina das amostras citológicas eram muito semelhantes à imunomarcação nas camadas mais superficiais das amostras teciduais[41].
Análises imunocitoquímicas associadas com técnicas quantitativas tradicionais podem detectar mais facilmente alterações associadas com a carcinogênese bucal. Um aumento na taxa de proliferação celular e a diminuição da marcação de E-caderina (proteína de adesão celular) foi observado em amostras de carcinomas bucais; assim como uma diminuição do percentual de células anucleadas foi relacionado com a marcação positiva de E-caderina em leucoplasias bucais[42].
A análise por Microscopia Eletrônica de Transmissão de células esfoliadas de mucosa bucal normal comparando com leucoplasias e CECs pôde demonstrar alterações citomorfológicas. As células neoplásicas malignas apresentaram uma diminuição das junções intercitoplasmáticas e interdigitações, e com isso a membrana citoplasmática tornou-se mais plana. Outro achado foi que o núcleo em ambas as lesões estudadas mostrou uma distribuição heterogênea, enquanto que nas células normais o conteúdo foi homogêneo[43]. As observações ultra-estruturais elucidaram as mudanças induzidas durante a carcinogênese.
A combinação de análises refina a avaliação citopatológica. Marcadores genéticos avaliados para a Perda de Heterozigosidade conjuntamente com a Análise de AgNORs demonstraram maior velocidade de proliferação e perda de heterozigozidade na região 9p21 nos indivíduos com leucoplasia bucal[44].
Múltiplos fatores contribuem para a baixa aplicabilidade clínica da citopatologia bucal, tais como: dificuldade na obtenção de uma amostra adequada[45], ocorrência de casos falso-negativos, principalmente em tumores com menos de dois centímetros[46] e a falta de conhecimento entre os cirurgiões-dentistas sobre os aspectos básicos da técnica[47].
Alguns detalhes são determinantes na análise citopatológica bucal:
Com o acúmulo de conhecimento na citopatologia bucal sugere-se que essa análise possa ser empregada no monitoramento de indivíduos expostos aos carcinógenos, devendo ser utilizado em nível individual e com avaliações longitudinais, bem como com estudos multicêntricos com o objetivo de avaliar diferentes grupos populacionais. Ressalta-se que este método não deva substituir a biópsia e o exame histopatológico, e sim, servir de um meio de identificar alterações precoces que podem preceder o aparecimento clínico de lesões, alertando o cirurgião-dentista para o acompanhamento regular e rigoroso desse indivíduo.
Idealizamos a redação deste material a fim de estabelecer rotinas adequadas proporcionando uma padronização, treinamento e calibração dos pesquisadores envolvidos com essa promissora técnica para interpretação celular bucal. As rotinas apresentadas a seguir são aquelas empregadas no Laboratório de Patologia Bucal da Faculdade de Odontologia da Universidade Federal do Rio Grande do Sul. Neste momento, abordaremos a técnica de Papanicolaou, futuramente outras técnicas de citopatologia bucal serão ilustradas.
Um exame minucioso da cavidade bucal deve ser realizado com uma iluminação apropriada. Alguns sítios devem ser avaliados como: mucosa jugal, gengiva livre e inserida, palato duro e mole, assoalho bucal e língua. Caso o paciente apresente qualquer lesão de tecido mole (exceto gengivite ou periodontite), a citopatologia não está indicada, devendo-se avaliar a melhor opção para diagnóstico e tratamento do quadro apresentado.
Antes da realização dos esfregaços citopatológicos, deve-se identificar as lâminas de vidro (com o nome e sítio ou número de registro) com lápis na parte fosca e também o frasco porta lâminas.
Técnica preconizada por PAPANICOLAOU (1941), modificada pelo Serviço de Citologia do HCPA, utilizada pelo Laboratório de Patologia da FO - UFRGS.
O Carbonato de Lítio é utilizado para realçar o efeito da hematoxilina. Tal solução é preparada com 5 gramas deste carbonato para 2 litros de água destilada. Trocar a solução no momento que ocorrer turvamento. Composição do Policromo: 200 ml corante EA36 e 600 ml corante EA65 (proporção 3:1).
Para avaliação das amostras citopatológicas é necessário que as células estejam bem distendidas e não sobrepostas com o mínimo possível de artefatos. Ressalta-se que lesões com áreas ulceradas geralmente tem sobreposição de células inflamatórias e sanguíneas além de sujidades, porém se a visualização das células epiteliais é satisfatória, este material pode ser avaliado.
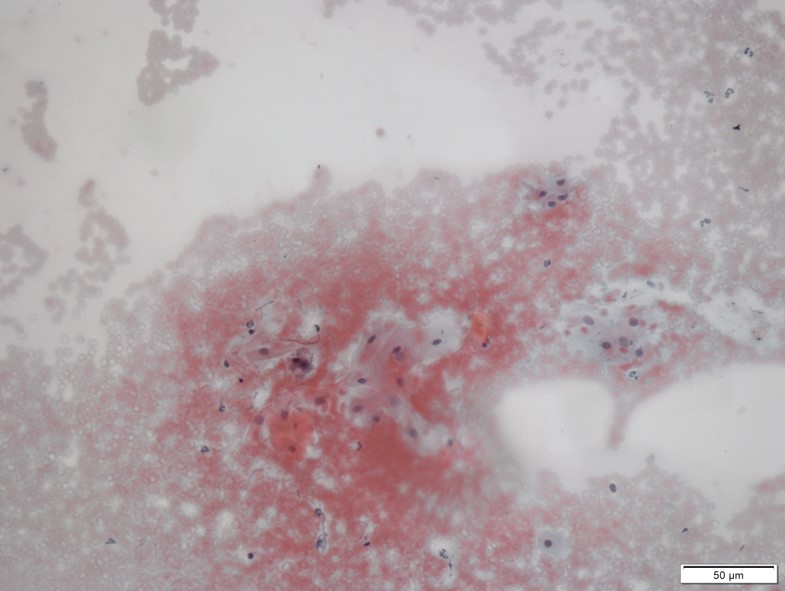
Consideram-se amostras insuficientes para análises quando há escassez de material, pois o tempo despendido para a interpretação da lâmina seria incompatível com a conclusão de avaliação (Figura 5). Amostras de lesão bucal maligna, como por exemplo, de Carcinoma Espinocelular, geralmente são examinadas para fins científicos de pesquisa (usados como controles positivos); uma vez que se há suspeita de neoplasias malignas já instaladas a biópsia e o exame histopatológico são imperativos.
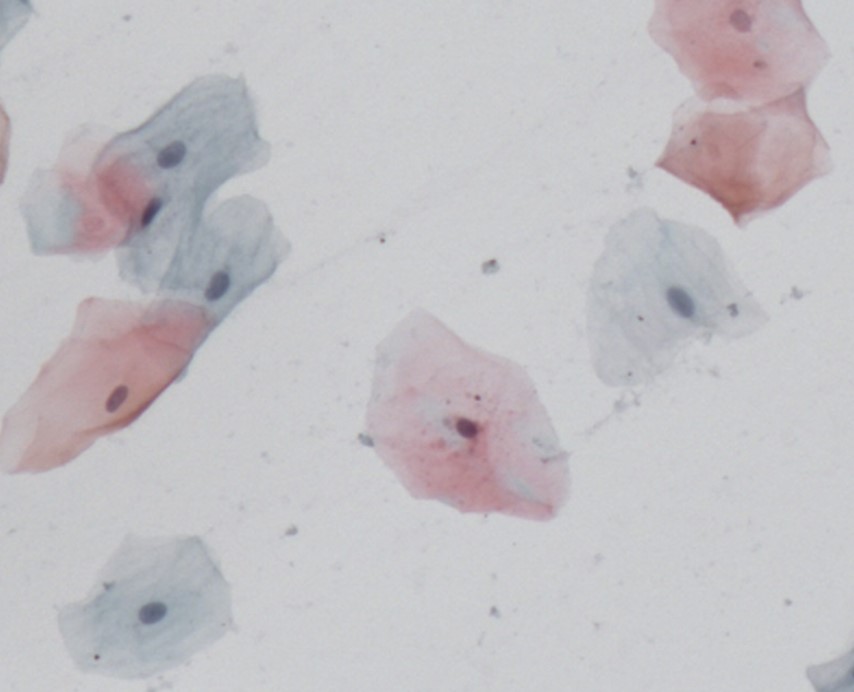
Exemplo de amostra adequada
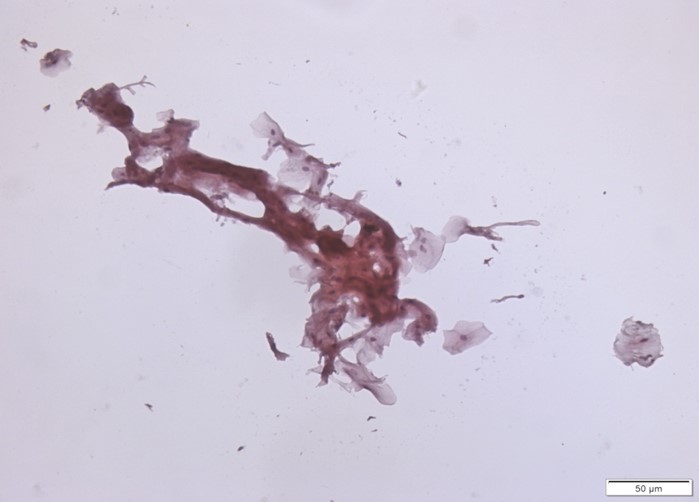
Exemplo de amostra inadequada
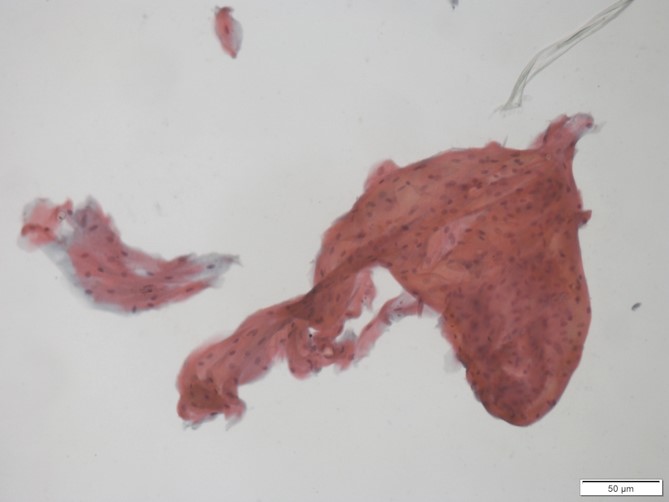
Exemplo de amostra insuficiente
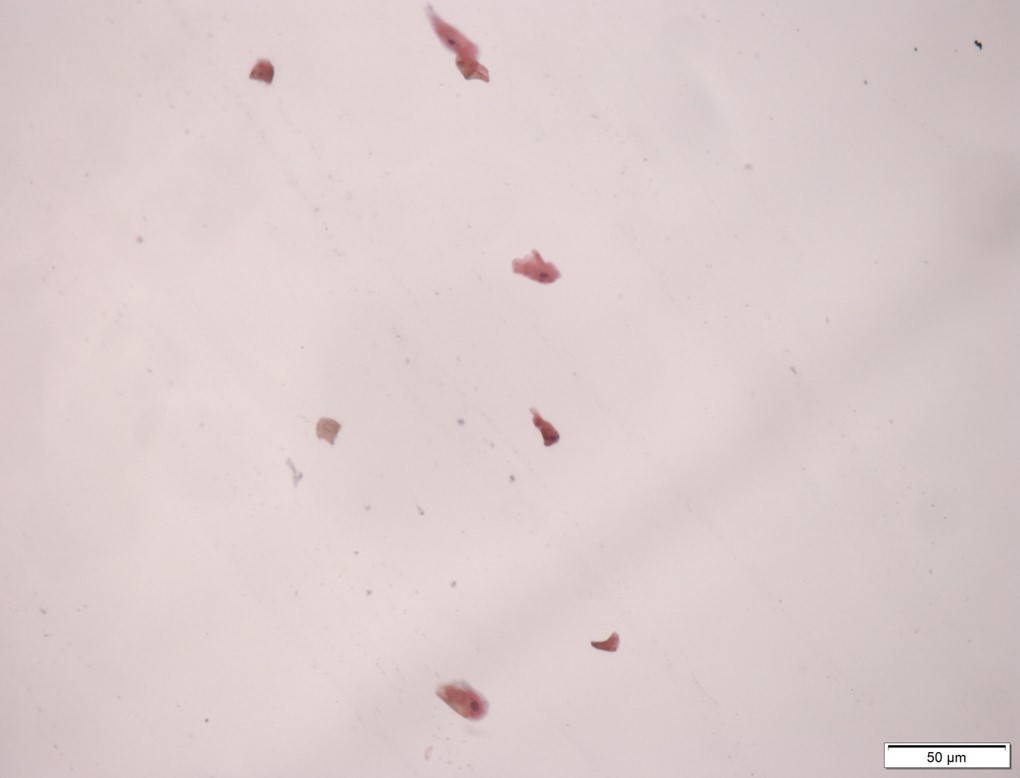
Exemplo de mostras de lesão bucal maligna
Para essa avaliação, caracterizam-se as 100 primeiras células bem distendidas e não sobrepostas avaliadas num aumento de 40 vezes.
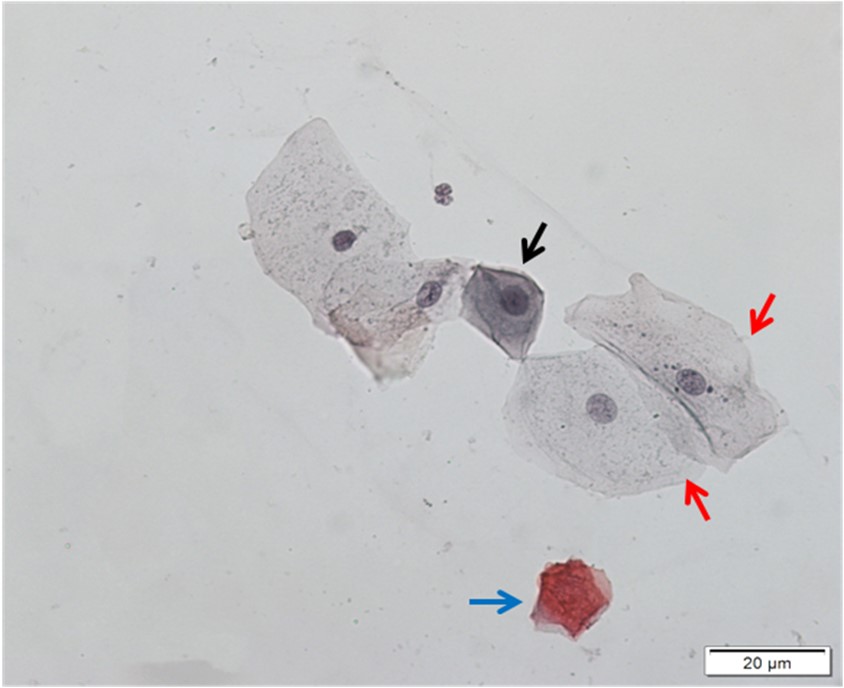
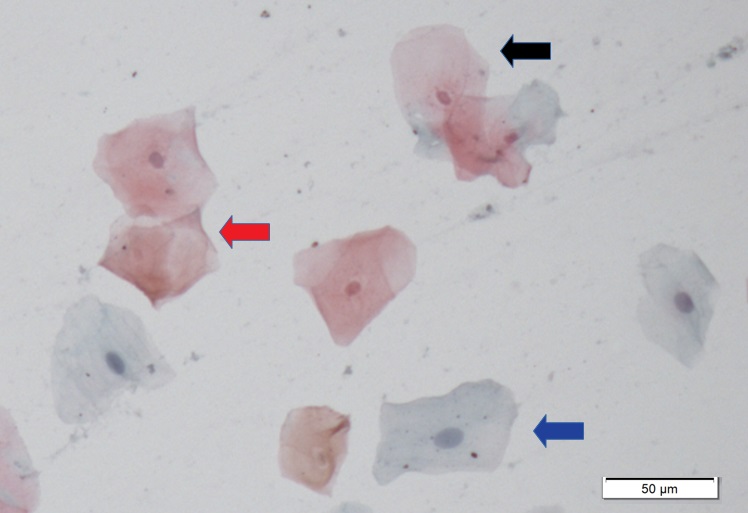
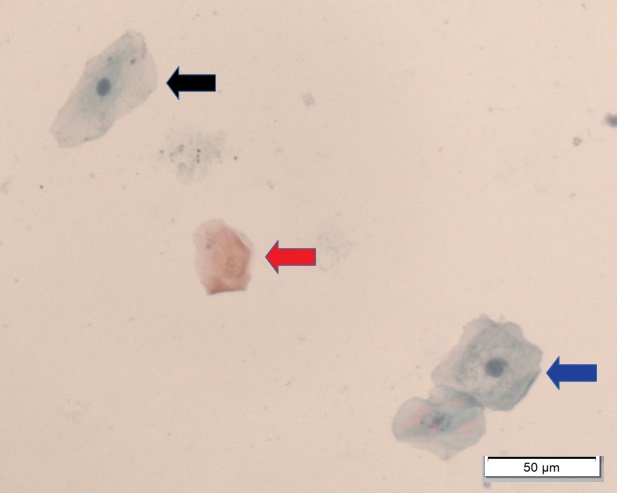
As células são então classificadas com relação ao estrato epitelial ao qual provavelmente pertenciam conforme a sua morfologia: células superficiais anucleadas ou com núcleo, intermediárias e parabasais. A seguir detalharemos características específicas de cada uma delas.
Células Superficiais Anucleadas (Escamas)
Células que apresentam citoplasma delicado, acidófilo e translucente. Normalmente de coloração acastanhada. Não apresentam núcleo. Podem ter grânulos de queratohialina intracitoplasmáticos.
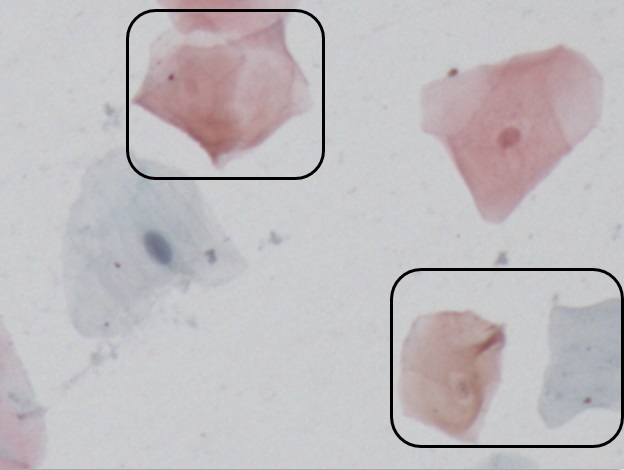
Células Superficiais com Núcleo
Células grandes e poligonais, com citoplasma abundante, usualmente acidófilo, podendo ser cianófilo. Seu núcleo é picnótico e hipercromático. Sua coloração compreende do laranja-avermelhado até o castanho-pálido.
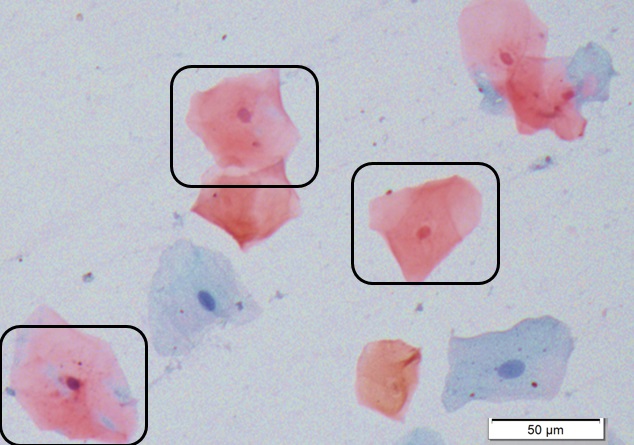
Células Intermediárias
Células com núcleos pálidos vesiculares maiores comparando-se com células superficiais. O citoplasma pode conter partículas de glicogênio, usualmente apresenta-se cianofílico podendo ser acidófilo.
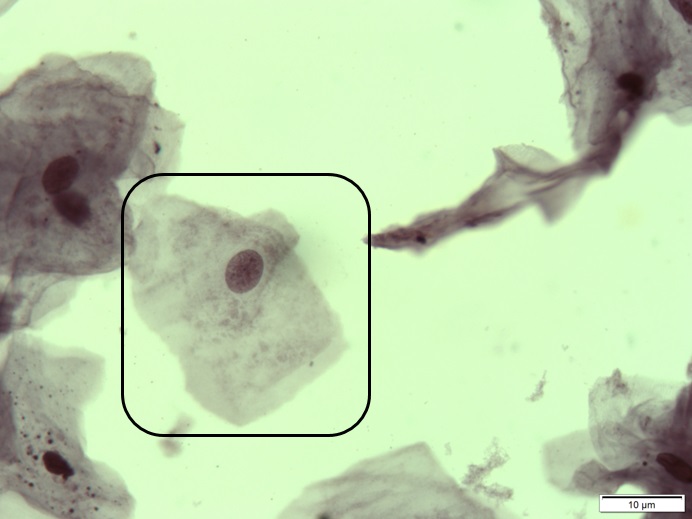
Células Parabasais
Estas células tendem a ter aspecto mais arredondado com núcleo abundante esférico central e citoplasma basofílico escasso. A relação núcleo citoplasma nessas células é maior. A membrana nuclear é suave e regular e a cromatina é pouco corada e delicada.
Para a análise qualitativa, a lâmina deve ser percorrida em toda a sua extensão, horizontalmente iniciando da esquerda para a direita em aumento 100x e, quando houver suspeita de alguma alteração, deve-se utilizar o aumento de 400X para visualização mais detalhada. Na tabela abaixo listamos possíveis alterações celulares observadas em raspados citopatológicos bucais[50].
| Alterações Celulares sugestivas de Atipia |
|---|
| Células epiteliais atípicas, hiperceratóticas, hipercromáticas |
| Presença de núcleos aumentados |
| Aumento da relação núcleo/citoplasma |
| Multinucleação |
| Alterações no padrão de distribuição da cromatina nuclear |
| Espessamento acentuado e irregular da membrana nuclear |
| Nucléolos múltiplos e proeminentes |
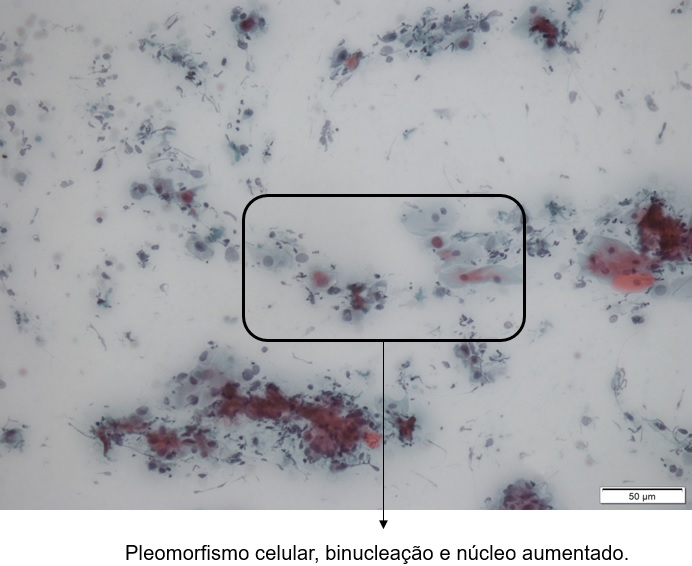
| Pleomorfismo nuclear |
| Bi ou multi-nucleação |
| Anisocitose |
| Mitoses atípicas |
O esfregaço será classificado em:
A classificação utilizada segue os critérios descritos por Papanicolaou e Traut (1943)[51], descritos abaixo:
Classe 0 - Amostra inválida
Material insuficiente ou inadequado para análise.
Classe I – Esfregaço Normal
As células observadas apresentam padrão normal em todo o esfregaço.
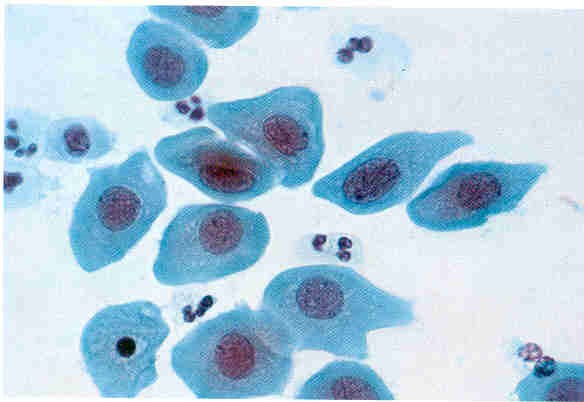
Classe II – Esfregaço Normal com Inflamação
As células observadas apresentam padrão normal em todo o esfregaço, porém verifica-se a presença de células inflamatórias em pelo menos dois campos.
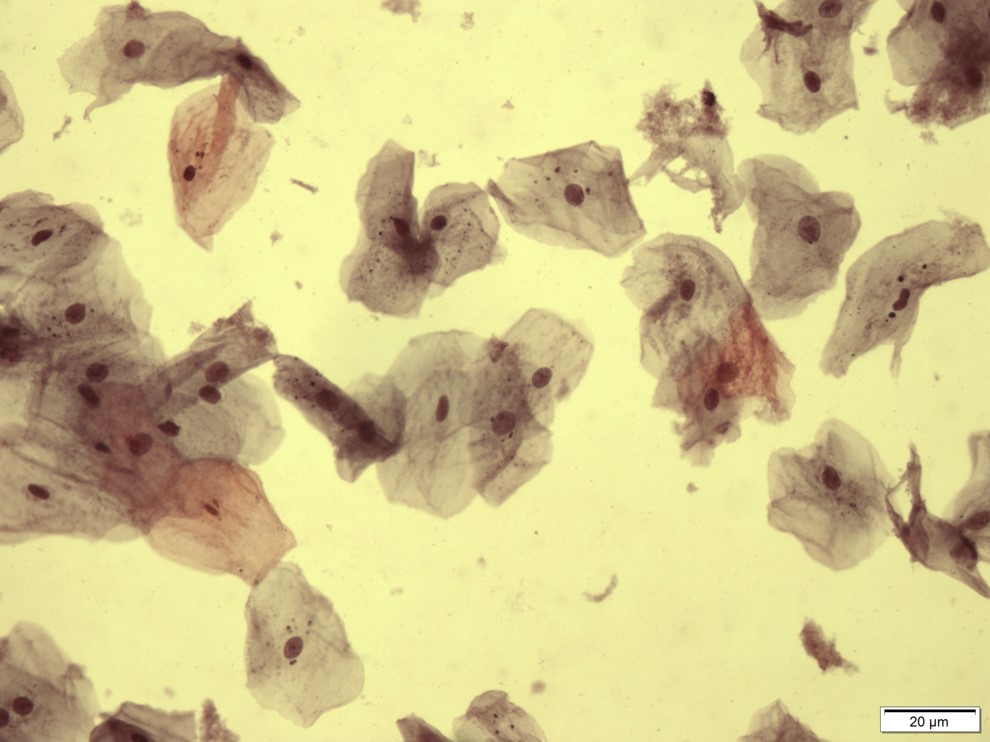
Classe III – Esfregaço Suspeito – Alterações Displásicas
Presença de alterações celulares em pelo menos dois campos do esfregaço. Tais alterações podem ser descritas como uma discreta hipercromasia nuclear, um leve aumento do tamanho nuclear e possível ocorrência de multinucleação celular.
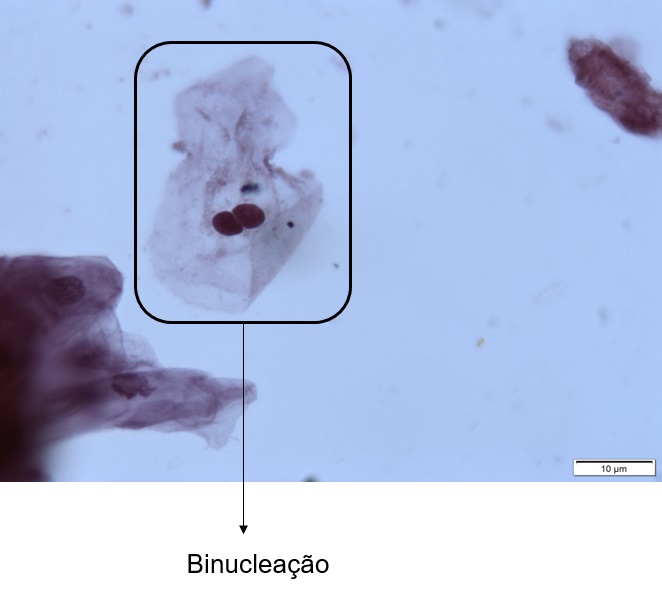
Classe IV – Esfregaço Sugestivo de Neoplasia Maligna- Carcinoma in Situ
Presença de alterações celulares em dois ou mais campos. Há um considerável número de células atípicas por esfregaço. O carcinoma in situ é caracterizado pela presença de células malignas imaturas (células da camada basal, redondas ou ovais, com núcleo em posição central). Podem ser observadas células com núcleos volumosos. Pode ser observada multinucleação. O citoplasma pode conter vacúolos.
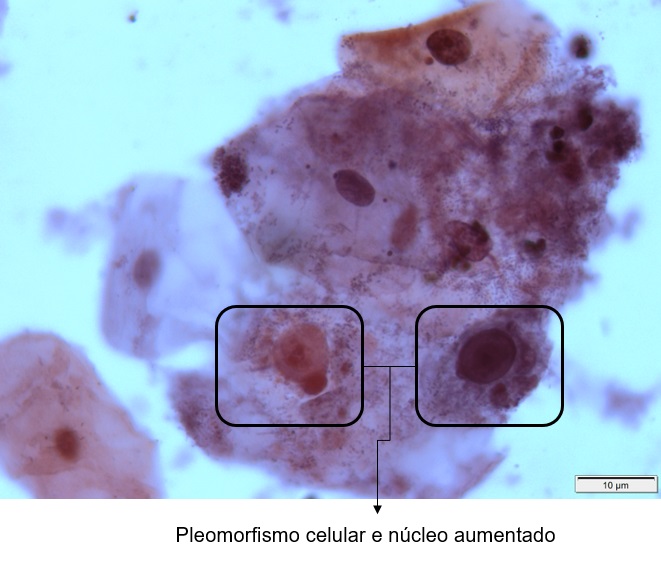
Classe V – Esfregaço Maligno – Carcinoma Invasivo
Presença de alterações celulares compatíveis com neoplasia maligna. O núcleo mostra grânulos grosseiros de cromatina, espaços vazios e pleomorfismo acentuado. Há evidente aumento da relação núcleo/citoplasma. O núcleo é hipercromático. Há presença de pleomorfismo celular e mitoses atípicas.
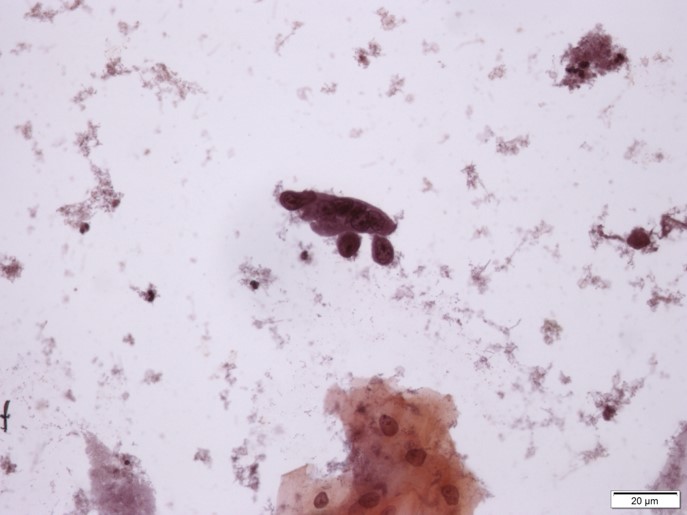
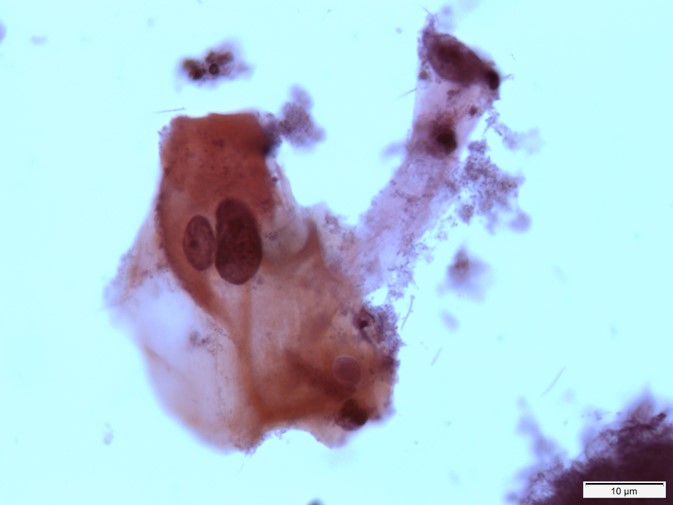
Quais estruturas estão identificadas pelas setas preta, vermelha e azul?
Quais estruturas estão identificadas pelas setas preta, vermelha e azul?
Quais estruturas estão identificadas pelas setas preta, vermelha e azul?
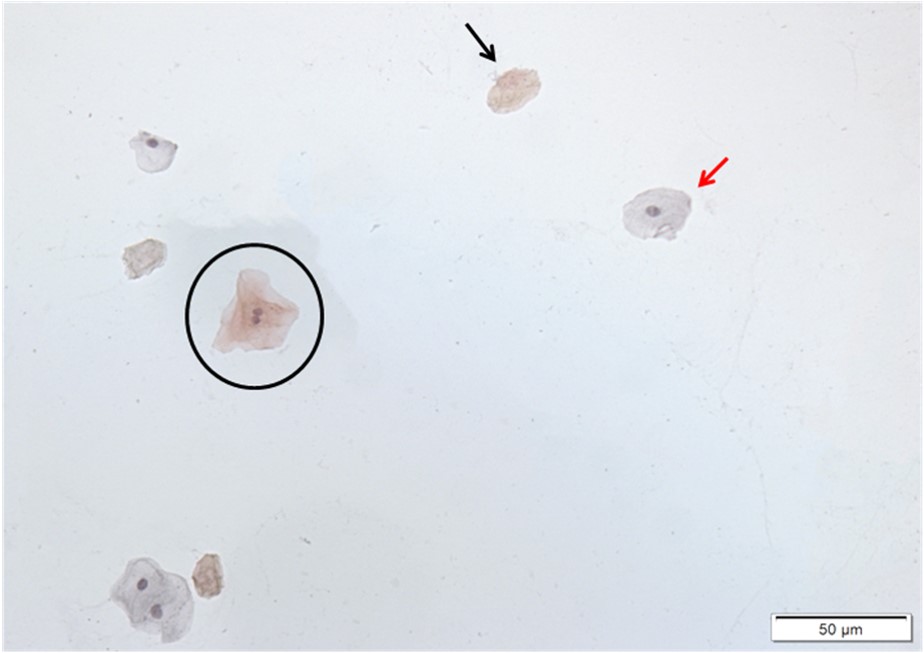
Quais estruturas estão identificadas pelas setas preta, vermelha e e pelo circulo preto?
Quais estruturas estão identificadas pelas setas pretas?
Podemos incluir as células que estão dentro do círculo preto na análise? Por que?
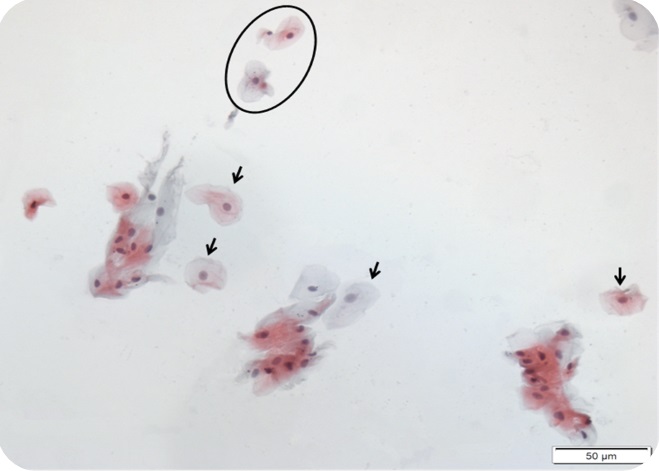
Podemos incluir as células que estão nesta imagem na análise? Por que?